grado 7 y 8 ENLACES QUIMICOS DE LEWIS
el enlace quimico de lewis y ejercicios
hola
debes trascribir al cuaderno toda la información y los dibujos
debes resolver los ejercicios propuestos, uniendo los atomos según la nomenclatura de lewis y las teorias de enlace quimico
si surgen dudas debes registrarlas en tu cuaderno y llevarlas al salon de clase
puedes buscar por google los terminos desconocidos y las reacciones que no entiendas bien
en youtube existen tutoriales al respecto para complementar tu formación
debes resolver los ejercicios propuestos, uniendo los atomos según la nomenclatura de lewis y las teorias de enlace quimico
si surgen dudas debes registrarlas en tu cuaderno y llevarlas al salon de clase
puedes buscar por google los terminos desconocidos y las reacciones que no entiendas bien
en youtube existen tutoriales al respecto para complementar tu formación
TÍTULO DE LA ACTIVIDAD:
|
enlaces quimicos
| ||
ELABORADO POR:
|
Hugo Vargas
| ||
ÁREA:
|
GRADO:
|
PERIODO:
| |
Biología
|
7 y 8
|
III
| |
COMPETENCIAS DEL ÁREA
| |||
Diferenciar y nombrar los principales tipos de enlaces quimicos
| |||
ESTÁNDARES
| |||
Explico la diversidad de la materia
| |||
CONTENIDOS TEMÁTICOS
| |||
BIBLIOGRAFÍA Y/O CIBERGRAFÍA
| |||
Audesirk et al. 2008. Biología: La vida en la tierra, 8ª edición, Pearson education. Mexico
| |||
Fuerzas entre los átomos
El enlace químico
Enlace : La fuerza que mantiene o une a dos átomos.
· Los átomos tratan de tener 8 electrones en la capa externa de valencia (regla octecto)
· Los metales pierden electrones para formar cationes con capa de valencia vacía. Li +
· Los no metales ganan electrones formando aniones con la capa de valencia llena. Cl -
Clasificación general de las fuerzas químicas:
Enlaces iónicos
Se puede describir por medio de un modelo electrostático que supone que los átomos que forman estos compuestos están como iones de carga opuesta, los cuales interactúan electrostáticamente.
En general los compuestos iónicos tienen un metal y un no-metal (sal Na+, Cl-)
Enlaces covalentes
El enlace covalente : Cuando dos elementos comparten sus electrones.
Para describir estos compuestos se requiere comprender que los elementos prefieren tener completas sus capas electrónicas y que en vez de perder o ganar electrones los comparten con este objetivo. (H-H) (Cl-Cl)
Típicamente los compuestos covalentes están formados por elementos no metálicos
El modelo de Lewis
G.N. Lewis, propuso que un átomo puede obtener la misma configuración de un gas noble simplemente compartiendo los electrones de otro átomo. De tal manera que por medio de esta operación se forma un enlace químico, al cual llamamos enlace covalente
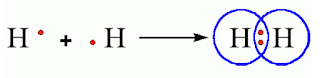
Así por ejemplo la molécula de (H2) es el ejemplo más simple de un enlace covalente el cual puede representarse por medio de su estructura de Lewis así: H . + H . = H:H
Al compartir un par de electrones cada hidrógeno tiene dos electrones en su capa de valencia, es decir el orbital 1s. En este sentido, tiene la configuración de un gas noble (He)
De la misma manera cuando dos átomos de Cl se unen covalentemente para formar la molécula de Cl2, los electrones que se comparten son: CL . + CL . = CL2 Ó CL: CL
Cada cloro comparte un par de electrones, el cual forma el enlace químico y con ello obtiene la configuración del gas noble Argón. En las estructuras de Lewis los electrones compartidos se dibujan como una línea y los electrones que no se comparten se dejan como puntos:
Ejemplos de enlaces covalentes del hidrogeno
Enlace múltiple
Cuando dos átomos del mismo elemento o de elementos diferentes, comparten un solo par de electrones, esto se considera un enlace covalente sencillo y curiosamente lo conocemos así: enlace sencillo.
Sin embargo, en muchas moléculas, para que los átomos puedan obtener la configuración de gas noble, necesitan compartir más de un par electrónico. Esto pueden hacerlo de varias maneras, la primera encontrar varios átomos con los cuales compartir más de un par de electrones, o bien por medio de compartir entre dos átomos más de un par electrónico a la vez.
Así tendremos que:
Cuando dos átomos comparten un solo par electrónico tenemos un enlace sencillo
Cuando dos átomos comparten dos pares de electrones tenemos un doble enlace
Este es el ozono
Cuando dos átomos comparten tres pares de electrones, tendremos el triple enlace
Debido a que el nitrógeno tiene 5 electrones de valencia, cada átomo de N requiere
compartir 3 pares para obtener su octeto.
Nótese entonces, que debido a lo anterior, el N2 tiene ciertas propiedades muy importantes:
El N2 bastante inerte, debido al triple enlace entre los dos nitrógenos, pues este es más fuerte que uno doble y todavía más que uno sencillo
Enlaces metálicos
En este caso el modelo que describe a estos elementos considera una especie de dicotomía, al tiempo que considera que los elementos prefieren tener sus configuraciones completas, también considera que para conseguirlo cada metal comparte electrones con varios vecinos.
De esta manera, los electrones de valencia pueden moverse libremente en tres
dimensiones. En general, este tipo de comportamiento lo muestran los elementos metálicos propiamente y todas las aleaciones. Oro, plata, cobre, aluminio
Símbolos de Lewis
Es un sistema sencillo que permite llevar la cuenta de los electrones alrededor de un átomo (inventado en 1915 por G.N. Lewis). Así, si conoces el número de electrones de valencia de un átomo es simple escribir el símbolo de Lewis.
Reglas básicas:
Escribe el símbolo atómico
Considera que cada lado puede tener hasta 2 e-
Tiende a llenar los electrones hasta obtener ocho en la capa externa lo que lo hace mas estable.
Cationes (carga positiva) Na+
Se forman al despojar a un átomo de uno o más electrones
Tienen desocupados los subniveles más externos
Aniones (carga negativa) Cl-
Se forman al añadir uno o más electrones de valencia
Tienen llenos los subniveles más externos
La fórmula de Lewis y la formación del NaCl
El electrón del Na se pasa al Cl, ambos átomos se han convertido en iones, el Na perdió un electrón y ahora su carga es 1+ y el Cl ganó un electrón, ahora su carga es 1-.
Los iones de cargas opuestas se atraen, de manera que ahora ya no se separan.
Tendencias periódicas, algunos no-metales
Hidrógeno
· El hidrógeno tiene una configuración electrónica 1s1 y se le pone encima de la familia de los metales alcalinos.
· Es un no-metal, que en condiciones normales es un gas (H2).
· Su primer potencial de ionización es considerablemente mayor que el de los metales alcalinos y se parece más al de los no-metales
· Generalmente reacciona con otros no-metales para formar compuestos moleculares en reacciones típicamente exotérmicas
· También reacciona con los metales para formar hidruros formando el ion H-: 2Na(s) + H2(g) = 2NaH(s)
· Puede perder un electrón para formar el ion H+ acuoso
Actividad una todos átomos propuestos con el hidrogeno.
Según los enlaces de Lewis en su cuaderno o en una hoja, se recogerá al final de la clase
elemento | unir el elemento de la izquierda (hidrógeno y luego oxigeno mas estos elementos) |
Nombre del compuesto
METANO CH4 | |
| Hidrogeno |
Metales grupo 1A
Na, K, Rb, Cs | ||
| oxigeno |
Metales grupo 1A
Na, K, Rb, Cs | ||
| hidrogeno |
Metales grupo 2A
MG, Ca, Sr, Ba | ||
| oxigeno |
Metales grupo 2A
MG, Ca, Sr, Ba | ||
| hidrogeno |
Otros METALES
Fe, Co, Ni, Cu, Zn, Ag, Au, Cd, Hg,
| ||
oxigeno
|
Otros METALES
Fe, Co, Ni, Cu, Zn, Ag, Au, Cd, Hg,
| ||
| hidrogeno |
grupo III A
metales Al, Ga, In, Tl y no metales B | ||
| hidrogeno |
grupo IV A
no metales C,
metales Si, Ge, Sn Pb
| ||
| hidrogeno |
grupo V A
no metales N, P, As
metales Sb Bi
| ||
| hidrogeno |
Grupo VI A
No metales Oxigeno, S, Se, Te, Po
| ||
| hidrogeno |
Grupo VII A
No metales F, Cl, Br, I, At
|
oxigeno
|
Otros METALES
Fe, Co, Ni, Cu, Zn, Ag, Au, Cd, Hg,
| ||
| oxigeno |
grupo III A
metales Al, Ga, In, Tl y no metales B | ||
| oxigeno |
grupo IV A
no metales C,
metales Si, Ge, Sn Pb
| ||
| oxigeno |
grupo V A
no metales N, P, As
metales Sb Bi
| ||
| oxigeno |
Grupo VI A
No metales Oxigeno, S, Se, Te, Po
| ||
| oxigeno |
Grupo VII A
No metales F, Cl, Br, I, At
|
Tipos de enlaces
En el siguiente cuadro indique que tipo de enlace se forma
Sustancia
|
Tipo de enlace
Iónico, covalente, metálico
|
Nombre de la sustancia
|
N2
| ||
O2
| ||
NH3
| ||
H2O
| ||
NaCL
| ||
MgCl
| ||
H2
| ||
N2
| ||
CO2
|











Comentarios
Publicar un comentario